◇エネルギー産生と物質代謝の基礎
がん細胞がなぜグルコースの取込みが多いのかを解説しています。
■
【ATPは細胞のエネルギー通貨】
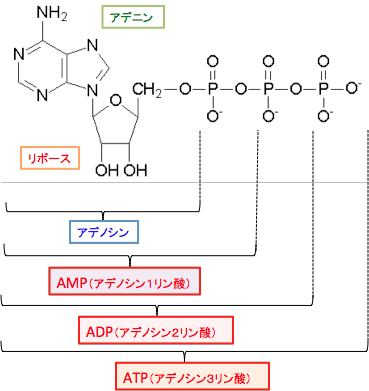
全ての真核生物は、細胞が活動するエネルギーとしてアデノシン三リン酸(Adenosine Triphosphate:ATP)というヌクレオチドを利用しています。ATPはアデノシンに化学エネルギー物質のリン酸が3個結合したもので、生物が必要とする活動エネルギーを保存した「エネルギー通貨」のような分子で、エネルギーを要する生物体の反応過程には必ず使用されています。
ATPがエネルギーとして使用されるとADP(Adenosine Diphosphate:アデノシン-2-リン酸)とAMP(Adenosine Monophosphate:アデノシン-1-リン酸)が増えます。
すなわち、ATP → ADP + リン酸 → AMP+2リン酸というふうに分解され、リン酸を放出する過程でエネルギーが産生されます(図)。
細胞はブドウ糖(グルコース)や脂肪酸に保存されているエネルギーをATP分子に捕獲し、筋肉の収縮や能動輸送や物質合成などの細胞の仕事に使っているのです。
 |
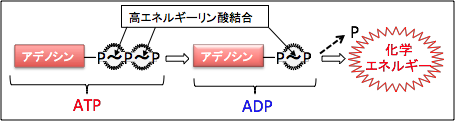 |
| 図:ATP(アデノシン3リン酸)は窒素性塩基であるアデニンがリボースに結合し、そのリボースに3つのリン酸基が並んで結合している分子です。ATPから加水分解によってリン酸基が外れるときにエネルギーが放出されます。 細胞は化学的な仕事を行うために必要なエネルギーの獲得と移動に関してATPを使用しており、ATPは生体内のエネルギー通貨として機能しています。 |
【食品からの栄養素を燃焼させて体を動かすエネルギーを作り出している】
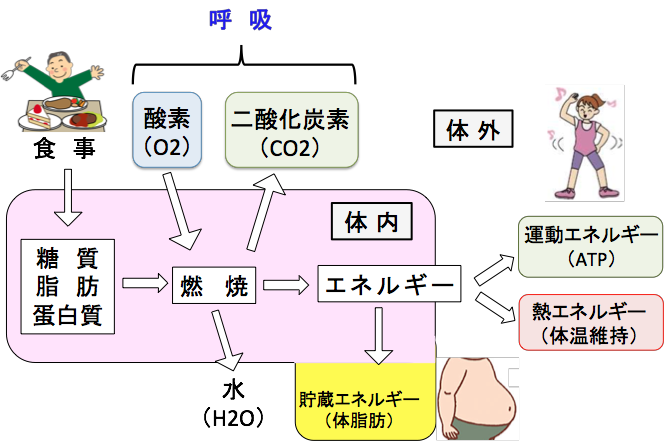
食事と呼吸と体内でのエネルギー産生のあらましを下図に示しています。私たちが食事によってエネルギー源として体内に取り入れる栄養素は糖質・脂肪・蛋白質で、これらを3大栄養素と言います。これらの栄養素は呼吸によって取り入れた酸素によってゆっくり燃焼してエネルギーを作り出し、体の運動や細胞の活動や体温維持など生命の維持に消費されます。摂取エネルギーが消費エネルギーより多いと余分なエネルギーは主に脂肪となって貯蔵されます。
食事から取り入れた栄養素(糖質・脂質・蛋白質)を呼吸で取り入れた酸素を使って燃焼することによってエネルギーが産生される。余ったエネルギーは体脂肪として貯蔵される。
【ブドウ糖(グルコース)を分解してエネルギー(ATP)を産生する】
まず、糖は体内でどの様に分解されるのでしょうか。食事を摂る事でその中のブドウ糖が体内に入ると解糖されピルビン酸になります。さらにそこから分解され、最終的にATP(アデノシン3リン酸)というエネルギーのもとに変わります。
その過程で酸素が充分にある状態とそうでない状態で分解のプロセスが変わります。
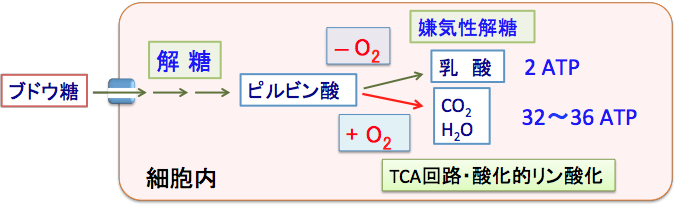
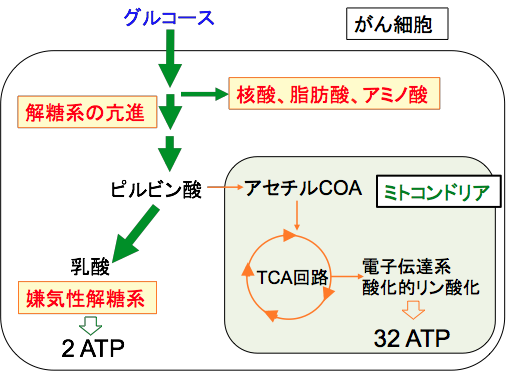
①酸素が十分な状態では・・・ ピルビン酸はミトコンドリア内に取り込まれ、酵素と結合したり回路を経由して二酸化炭素と水に分解されATPに変換されます(酸化的リン酸化)。②酸素が十分でない状態では・・・ ピルビン酸は細胞質で乳酸に分解されATPの生産を行います。 これを嫌気性解糖といいます。
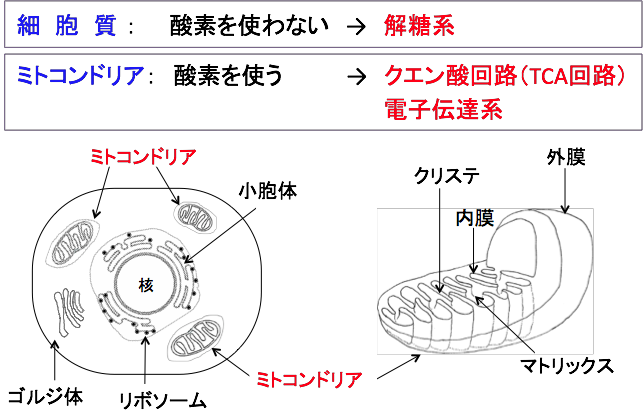
図:細胞内に取込まれたブドウ糖は、細胞質で酸素を使わない方法でピルビン酸まで分解される。これを解糖という。さらに、ミトコンドリアで酸素を使って分解される。
図:ブドウ糖は細胞質内で解糖によってピルビン酸に代謝される。酸素が十分に無い条件では、さらに細胞質内で乳酸まで分解される(嫌気性解糖という)。酸素が十分にある条件では、ミトコンドリアでTCA回路(クエン酸回路)と酸化的リン酸化によって、水と二酸化炭素まで分解される。1分子のブドウ糖当たり、嫌気性解糖では2分子のATPしか産生できないが、ミトコンドリアで酸化的リン酸化で完全に燃焼されれば、1分子のブドウ糖当たり32〜36分子のATPが精製される。
【がん細胞はミトコンドリアでの酸化的リン酸化が抑制されている】
がん細胞が数を増やしていくには、莫大なエネルギー(ATP)と細胞を構成する成分(タンパク質や脂質や核酸)が必要です。がん細胞では正常細胞に比較して、数倍から数十倍のエネルギー産生と物質合成が行われています。
酸素を使った酸化的リン酸化では1分子のグルコースから32分子のATPを産生できるのに、嫌気性解糖系では2分子のATPしか産生できません。(注;酸化的リン酸化で生成するATPの量は1分子のグルコース当たり30〜38分子といろんな説があり確定していませんが、ここでは米国の生物学の教科書の”Life:the Science of Biology”の記述に準拠して32分子にしています)
さて、がん細胞では酸素が十分に利用できる状況でも、ミトコンドリアでの酸化的リン酸化が抑制され、解糖系でのATP産生に依存しています。
解糖系に依存したATP産生は非効率的で増殖には不利のはずです。1分子のグルコースから産生されるATPの量は、ミトコンドリアで完全に分解されると32分子であるのに対して、解糖系だけでは2分子しかできません。
しかし、がん細胞がエネルギー産生効率を犠牲にして酸化的リン酸化を抑制するのには訳があります。それは、細胞構成成分を合成する材料として多量のグルコースが必要になっているためです。
細胞が分裂して数を増やすためには核酸や細胞膜(主に脂質から構成される)やタンパク質(アミノ酸から合成される)などの細胞構成成分を新たに作る必要があります。細胞は、解糖系やその経路から派生するペントース・リン酸経路などの細胞内代謝系によってグルコースの炭素骨格から核酸や脂質やアミノ酸を作ることができます。
つまり、エネルギー産生と物質合成を増やすという2つの目的を両立させるために、必然的にミトコンドリアでの酸化的リン酸化が抑制され、解糖系に依存したエネルギー代謝が亢進し、グルコースの取込みが亢進していると考えられます。
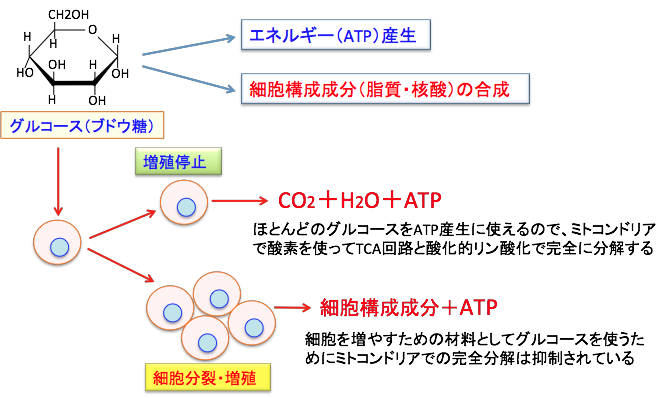
ミトコンドリアでグルコースの炭素骨格を全て二酸化炭素(CO2)と水(H2O)に分解すると細胞分裂のための細胞構成成分が作れなくなることが酸化的リン酸化を抑制せざるを得ない理由の一つと言えます(下図)。
また、ミトコンドリアでの酸化的リン酸化は活性酸素を産生するので、細胞内の酸化ストレスが高まると細胞死を引き起こす原因になります。がん細胞は死ににくくするためにミトコンドリアの活性を抑制しているという考えもあります(後述)。
図:細胞はグルコースを分解してエネルギー(ATP)を産生し、その炭素骨格を利用して核酸や脂肪酸などの細胞構成成分を合成する。細胞が増殖を停止している場合は、細胞分裂のための細胞構成成分を作る必要がないので、取り込んだグルコースのほとんどをATP産生に使えるので、ミトコンドリアで酸素を使って二酸化炭素と水にまで完全に分解することができる。一方、細胞分裂して増殖している場合は、細胞を増やすために細胞構成成分(細胞膜や核酸など)を合成する材料としてグルコースを使うため、必然的にミトコンドリアでの完全分解は抑制され、解糖系とペントース・リン酸経路でのエネルギー産生と物質合成の両方が亢進することになる。
【がん細胞では酸素があっても解糖系が亢進している】
正常細胞とがん細胞ではエネルギー産生の状況に大きな違いがあります。
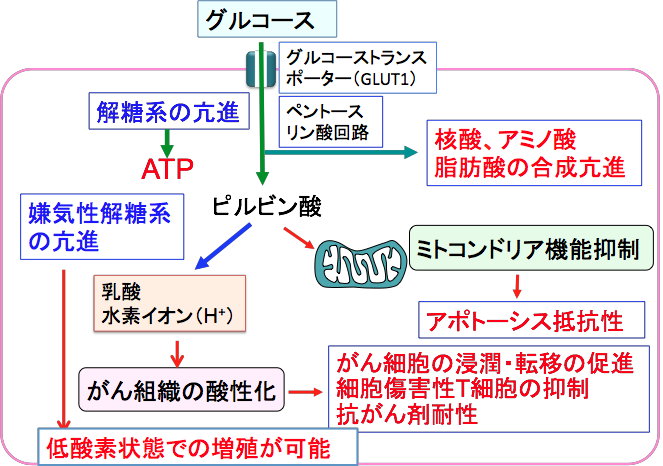
正常細胞ではミトコンドリアで酸素を使って効率的にエネルギー(ATP)を産生しているのに対して、がん細胞では酸素がある状況でもミトコンドリアでの酸素を使ったエネルギー産生(酸化的リン酸化)は抑制され、細胞質における解糖系によるATP産生が亢進しています(図)。このがん細胞における解糖系の亢進は80年以上前にオットー・ワールブルグ博士(Otto Warburg、1883年~1970年)により発見されました。
図:がん細胞ではグルコースの取込みと解糖系でのATP産生が亢進している。酸素が十分に利用できる状況でも、ミトコンドリアでのTCA回路と酸化的リン酸化によるATP産生は低下している。 ワールブルグは呼吸酵素(チトクローム)の発見で1931年にノーベル生理学・医学賞を受賞したドイツの生化学者です。細胞生物学や生化学の領域で重大な基礎的発見を次々に成し遂げ、呼吸酵素以外の研究でも何回もノーベル賞候補になった偉大な科学者です。そのワールブルグが最も力を注いだのががん細胞のエネルギー代謝の研究です。がん細胞の異常な増殖を解明するためには、エネルギー生成の反応系を研究しなければならないということから、呼吸酵素を発見しています。
そして、がん細胞ではグルコースから大量の乳酸を作っていること、がん細胞は酸素が無い状態でもエネルギーを産生できること、さらに、がん細胞は酸素が十分に存在する状態でも、酸素を使わない方法(解糖系)でエネルギーを産生していることを見つけています。
がん細胞ではミトコンドリアにおける酸化的リン酸化によるエネルギー産生が低下し、細胞質における解糖系でのエネルギー産生が増加している現象はワールブルグ効果(Warburg effect)として知られていますが、この現象が発見されたのは80年以上も前(1926年)のことです。
ワールブルグ自身は、ミトコンドリアにおける酸化的リン酸化の機能欠損が細胞のがん化の原因だと考えていました。しかし、その後の研究で、多くのがん細胞においてミトコンドリアの機能自体は障害されていないことが明らかになっています。
そこで、がん細胞が解糖系を好む理由とそのメカニズムの解明が、がん研究における重要なテーマになっています。様々ながん遺伝子の異常や活性化が、がん細胞のワールブルグ効果の成り立ちに関与していることが明らかになっています。
【ワールブルグ効果はがん細胞の生存と増殖を助ける】
がん細胞におけるグルコースの取込みと解糖系の亢進の主な理由は、前述のように細胞分裂のための物質合成とエネルギー産生を増やすためですが、その他にもワールブルグ効果にはがん細胞の生存と増殖において次のような様々なメリットがあることが指摘されています。
①ミトコンドリアでの酸化的リン酸化が低下するとがん細胞が死ににくくなることが知られています。細胞分裂しない神経や筋肉細胞を除いて、正常の細胞は古くなったり傷ついたりするとアポトーシスというメカニズムで死にます。このアポトーシスを実行するときに、ミトコンドリアの電子伝達系や酸化的リン酸化に関与する物質(チトクロームCなど)が重要な役割を果たしています。がん細胞ではアポトーシスを起こりにくくするために、あえてミトコンドリアにおける酸化的リン酸化を抑え、必要なエネルギーを細胞質における解糖系に依存しているという考えが提唱されています。
実際に、がん細胞のミトコンドリアにおける酸化的リン酸化を薬(ジクロロ酢酸ナトリウムなど)で活性化させるとがん細胞にアポトーシス(細胞死)を引き起こすことができることが報告されています。
②解糖系でのグルコースの代謝によって乳酸が増えると、がん組織が酸性になり、がん細胞の浸潤や転移に好都合になります。組織が酸性化すると正常な細胞が弱り、結合組織を分解する酵素の活性が高まるため、がん細胞が周囲に広がりやすくなります。組織の酸性化は血管新生が誘導するという報告もあります。
さらに乳酸には、がん細胞を攻撃する細胞傷害性T細胞の増殖やサイトカインの産生を抑制する作用があり、がんに対する免疫応答を低下させる作用もあります。酸性の組織には抗がん剤が到達しにくいことも指摘されています。
③解糖系でエネルギーを産生することは、血管が乏しい酸素の少ない環境でも増殖が可能になります。
つまり、がん細胞の生存に有利に働くように代謝が変化した結果がワールブルグ効果と言えるのです。(下図)。
図:がん細胞ではグルコース(ブドウ糖)の取り込みと嫌気性解糖系が亢進し、ミトコンドリアでの酸化的リン酸化が抑制されている。この現象(ワールブルグ効果)は様々な点でがん細胞の増殖や生存に有利な効果を与えている。
【がん細胞はグルコースの取込みが増えている】
細胞増殖が盛んながん細胞では栄養素の必要量が高いのは当然です。がん細胞ではグルコース(ブドウ糖)やアミノ酸の取込みが亢進していることは良く知られています。
グルコースやアミノ酸は、それぞれの輸送担体(トランスポーター)を使って細胞膜を通過します。グルコースもアミノ酸も水溶性なので、細胞膜をそのままでは通過できないためです。
がん細胞では、グルコースを取込むグルコース輸送担体(グルコース・トランスポーター)の発現量が増え、大量のグルコースを取りこんで、エネルギー産生と物質合成の材料に使っています。さらに、がん細胞では、多くの必須アミノ酸の取込みを担う中性アミノ酸トランスポーターのLAT1(L-type amino acid transporter)の発現が高まっています。LAT1は、ロイシン、イソロイシン、バリン、フェニルアラニン、チロシン、トリプトファン、メチオニン、ヒスチジンなど大型側鎖をもつ中性アミノ酸を輸送し、多くのがん細胞でLAT1の発現が亢進しています。
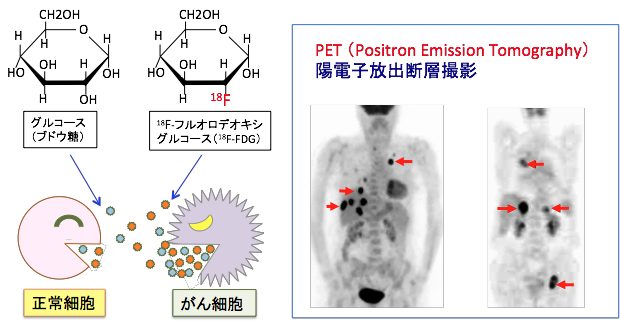
がん細胞がグルコースの取込みが多いことはPET(Positron Emission Tomography:陽電子放射断層撮影)検査でも示されています。これはフッ素の同位体で標識したグルコース(18F-fluorodeoxy glucose)を注射して、この薬剤ががん組織に集まるところを画像化する検査法で、正常細胞に比べてグルコースの取り込みが非常に高いがん細胞の特性を利用した検査法です(下図)。
図:がん細胞は正常細胞に比べて大量のグルコースを消費している。このがん細胞の特徴を利用した検査法がPET(Positron Emission Tomography:陽電子放出断層撮影)検査である。18F-FDGはグルコースの2位の水酸基を陽電子(Positron)放出核種であるフッ素18で置換した誘導体で、グルコースの取込みが多いがん細胞は18F-FDGの取込みが多いので、がん組織を検出できる。右写真の矢印で示す黒い部分ががん組織。
中性アミノ酸トランスポーターのLAT1の発現はがん特異性が高いので、LAT1で選択的に取込まれる化合物にアイソトープを標識すると、がん組織を検出でき、その特異性と感度はPET検査より高いという報告もあります。
このように、がん細胞ではグルコースやアミノ酸の細胞内取り込みを行うトランスポーターの量が正常細胞に比べて非常に多くなっており、これらのトランスポータの発現量が多いがん細胞ほど、増殖速度が早く、予後が悪いという研究結果も報告されています。
したがって、グルコースやアミノ酸のトランスポーターの働きを阻害したり、トランスポーターの量を減らすと、がん細胞の増殖を抑えることができます。あるいは、これらのトランスポーターを使ってがん細胞に毒になる物質を取り込ませれば、がん細胞に選択性の高い治療法になります。
【糖質摂取を減らすとがん細胞の増殖が抑制される】
がん細胞はグルコース(ブドウ糖)を取込むグルコーストランスポーター1(GLUT1)の発現量を増やすことによってグルコースの取込みを増やしています。正常細胞に比べてグルコースの取り込みが非常に高いがん細胞の特性はPET検査でも示されています。
糖質の多い食事ががんの発生率を高め、がん細胞の増殖や転移や再発を促進することは、多くの動物実験や臨床試験で報告されています。がん細胞が増殖するためにはエネルギーと細胞と作る材料が必要ですが、そのエネルギー産生と物質合成の材料が糖質を分解してできるグルコースだからです。
したがって、糖質摂取を減らしてがん細胞へのグルコースの利用を減らすことでがん細胞の増殖抑制効果が得られる可能性があります。
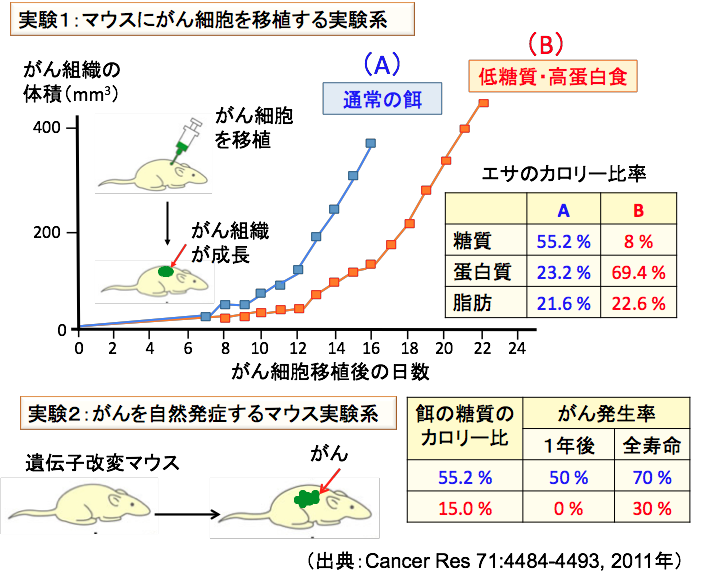
実際に、マウスにがんを移植する実験系では、エサの糖質のカロリー比減らすことでがん細胞の増殖抑制効果が認められています。さらに、遺伝子改変によってがんを自然発症するマウスの実験では、糖質摂取を減らすことでがんの発生予防効果が示されています(Cancer Res. 71(13): 4484-93, 2011年)。
この実験では、カロリー摂取量は変えずに、糖質の摂取量を減らし、減ったカロリー分はタンパク質を増やして補うような食餌のパターンで、糖質制限による抗腫瘍効果を検討しています。
通常食のカロリー比は糖質が55.2%、タンパク質が23.2%、脂質が21.6%です。 糖質のカロリー比を15%、10%、8%にしたエサを使っています。これら低糖質食のエサでは、減ったカロリー分をタンパク質で補っています。すなわち、脂肪の摂取量は通常食とほぼ同じで、タンパク質のカロリー比が60~70%程度に高くなっています。つまり、低糖質+高タンパク質の食餌の抗腫瘍効果が検討されています。
マウスにがん細胞を移植する実験系では、マウスの扁平上皮がんVII (SCCVII) とヒト大腸がん細胞(HCT-116)が使われ、マウスに移植して週に2~3回腫瘍組織の大きさを測定して体積を計算で求めています。
別の実験系では、がん遺伝子のHER2/Neuを過剰発現させるように遺伝子改変したマウスが使われています。この遺伝子改変マウスは通常のエサで飼育すると全寿命の期間に70%程度の割合でがんを自然発症します。このがんの発症率(がん組織が触れるようになった時点で発症と認定)が糖質制限で抑制されるかどうかを検討しています。
その結果、糖質8%の食餌で飼育したマウスに移植したがんは通常食のがんの増殖に比べて、その増殖速度が半分以下になりました。たとえば、がんを移植して16日後の腫瘍の体積は、通常食では364.3 ± 85.01 mm3であったのに対して、8% 糖質群では130.9 ± 21.76 mm3と半分以下でした。
ただし、8%糖質の場合には、体重の減少が認められたので、カロリー制限の影響があるかもしれないということで、10%糖質と15%糖質での検討が行われています。 糖質のカロリー比が10%と15%の場合は通常食(糖質のカロリー比が55.2%)と比べて体重の差は認めませんでしたが、8%糖質の場合と同様にがん組織の増大速度は低下していました。
例えば、SCCVII細胞を移植して16日後の腫瘍の体積は、通常食群では542.9 ± 78.80 mm3であったのに対して15%糖質群では 321.0 ± 79.79 mm3 でした。 つまり、糖質が少ないほどがん組織の増大速度は低下しますが、10%でも15%でも、体重の変化を起こさずに、有意にがんの増殖を抑えることが確認されています。
また、がんを自然発症する遺伝子改変マウスを使った実験では、通常食(糖質のカロリー比が55.2%)では1年後のがん発生率は50%、全寿命の期間では70%のマウスにがんが発生しましたが、糖質を15%に制限した食餌では、1年後の発症率は0%、全寿命期間でも30%でした。糖質摂取の割合を減らすほど、がんの発生率が低下していました。
さらに、がんの治療薬との併用でも、糖質を制限することによって、その治療効果が増強することが示されています。例えば、シクロオキシゲナーゼ-2阻害剤のcelecoxibのがん細胞の転移抑制効果は糖質制限によって増強されました。
以上のような結果から、この論文では「糖質制限はがんの発生や増殖を抑制する効果がある」という結論になっています。
図:実験①:エサの糖質のカロリー比を8%に減らし、減ったカロリー分をタンパク質で増やす低糖質・高タンパク食で飼育すると、通常のエサ(糖質のカロリー比が55.2%)で飼育した場合に比べて、腫瘍の増大速度は半分以下に遅くなった。糖質を10%や15%に減らした低糖質食でも同様の腫瘍抑制効果が認められ、糖質摂取量が少ないほど腫瘍抑制効果が高かった。
実験②:がんを自然発症するように遺伝子改変マウスを使った実験系では、糖質のカロリー比を減らすと、がんの発生率が低下した。(出典:Cancer Res 71:4484-4493, 2011年) 。
【人間のがんでも糖質摂取を減らすとがん細胞の増殖がストップする】
絶食して体内の脂肪が燃焼しだすとケトン体(アセト酢酸とβ-ヒドロキシ酪酸)という物質が血中に増えます。ケトン体は、ブドウ糖の摂取が少ないときに脂肪が分解して生成され、ブドウ糖の代わりに脳やその他の臓器のエネルギー源となります。糖質摂取を極端に減らし、脂肪摂取を増やしてケトン体の産生を増やすケトン食が、がん細胞の増殖を抑える効果があることが報告されています。
米国ニューヨーク州のアルバート・アインシュタイン医科大学の放射線科のグループが、糖質制限食の安全性と有効性を検討する目的で、10例の進行がん患者を対象に臨床試験を行っています。
この研究では、根治治療不可能な進行がん患者でPET検査で腫瘍を検出し、全身状態が比較的良く、諸臓器機能が正常で糖尿病が無く、最近の体重減少を認めず、BMI(Body Mass Index)が20kg/m2以上の条件を満たす10例を対象に、26〜28日間の糖質制限食を実施しています。
その結果、食事療法開始前に腫瘍の早い進行を認めていた9例のうち5例で病状安定(stable disease)あるいは部分奏功(partial remission)をPET検査で確認できました。病状安定とはがんが大きくならなかったことで、部分奏功とは画像検査で長径が30%以上(あるいは面積が50%以上)縮小した場合を言います。効果を認めたこの5例は、進行を続けた4例と比較して、血中のケトン体の量が3倍くらい高かったという結果でした。腫瘍増殖の抑制を認めた5例と進展した4例の間には、カロリー摂取や体重減少の程度には差を認めませんでしたが、ケトン症のレベルは血清インスリンの濃度と逆相関の関係にありました。(Nutrition 28(10): 1028-35, 2012年)
つまり、この臨床試験では、「インスリンの分泌を阻害する食事療法(糖質制限によるケトン食)は進行がん患者において安全に実施できる」「この食事療法による抗腫瘍効果(病状安定および部分奏功)は、摂取カロリーや体重減少の程度とは関係せず、ケトン症の程度(血中ケトン体の濃度)に相関する」という2点が確認されています。
インスリンががん細胞の増殖を促進することは十分な根拠があります。インスリンの分泌を少なくする糖質制限食ががん細胞の増殖を抑制することも多くの動物実験や臨床試験などで証明されています。さらに、ケトン体ががん細胞の増殖を抑制する効果があり、糖質制限と高脂肪食によるケトン食が抗がん作用を示すことも最近多くの研究で明らかになっています。さらにこの報告は、進行がんの治療としてケトン食が十分に効果が期待できることを示しています。
この研究で最も重要な結果は、血中のケトン体濃度が高いほど、がん細胞の増殖抑制効果が高いという点です。カロリー摂取や体重減少とは関連せず、ケトン体の血中濃度のみが奏功率と関連するということです。糖質制限だけでもがん細胞の増殖を抑制する効果が得られますが、高脂肪食によってケトン体を増やす工夫も重要だということです。