ケトン体・ケトン食とは :
ケトン体とケトン食の基礎知識を解説しています。
【脂肪が燃焼するとケトン体ができる】
ブドウ糖が枯渇した状態で脂肪酸が燃焼するとき、肝臓ではケトン体(アセト酢酸とβ-ヒドロキシ酪酸)という物質ができます。このケトン体は脳にエネルギー源を供給するために肝臓で作られる物質です。
通常、脳はブドウ糖しかエネルギー源として利用できません。脂肪酸は血液脳関門を通過できないので、脳は脂肪酸をエネルギー源として利用できません。体はブドウ糖が枯渇したときに脳のためにエネルギー源を作らなければなりません。そこで、肝臓では脂肪酸を分解する過程でケトン体を生成するように進化したのです。
ケトン体は水溶性で細胞膜や血液脳関門を容易に通過し、骨格筋や心臓や腎臓や脳など多くの臓器に運ばれ、これらの細胞のミトコンドリアで代謝されてブドウ糖に代わるエネルギー源として利用されます。特に脳にとってはブドウ糖が枯渇したときの唯一のエネルギー源となります。
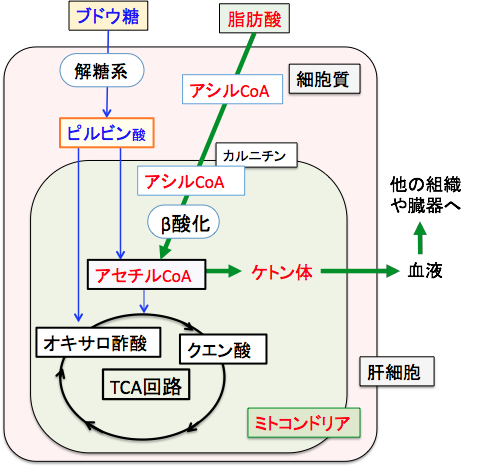
通常は、細胞が必要なエネルギー(ATP)は、グルコースが解糖系からピルビン酸とアセチルCoAを経てTCA回路(クエン酸回路)へと代謝され、さらに酸化的リン酸化によって産生されます。
一方、脂肪酸からエネルギーを産生する場合は、脂肪酸が分解(β酸化)されてアセチルCoAになり、このアセチルCoAがミトコンドリアのTCA回路で代謝されてATPを作り出します。
脂肪酸の酸化で作られるアセチルCoAの多くはTCA回路(クエン酸回路)に入りますが、絶食時などブドウ糖が少ない状況ではアセチルCoAをTCA回路で処理する時に必要なオキサロ酢酸ができないため、TCA回路が十分に回りません。そのためTCA回路で処理できなかった過剰のアセチルCoAは肝臓でケトン体の合成に回されます(図)。
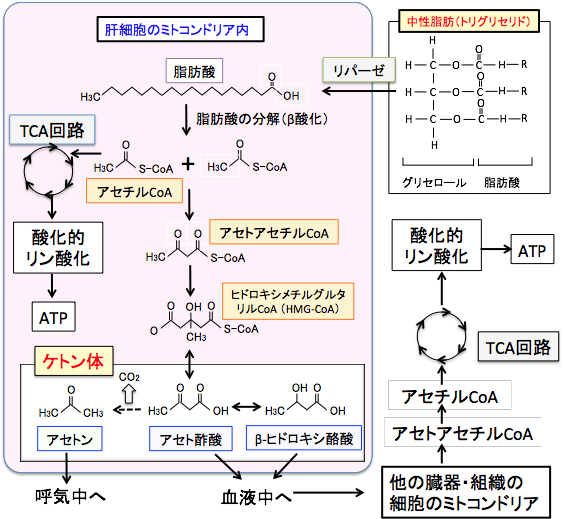
図:TCA回路の最初のステップはアセチルCoAとオキサロ酢酸が結合してクエン酸になる反応で、オキサロ酢酸はピルビン酸からできるので、ブドウ糖が制限された条件では、アセチルCoAはケトン体合成へ振り分けられる。この図で長鎖脂肪酸がミトコンドリアに入る場合はL-カルニチンが必要であるが、中鎖脂肪酸の場合はL-カルニチンは必要ない。 すなわち、肝細胞では、脂肪酸が分解されてできたアセチルCoAの一部はアセトアセチルCoAになり、3-ヒドロキシ-3-メチルグルタリル-CoA(HMG-CoA)を経てアセト酢酸が生成され、これは脱炭酸によってアセトンへ、還元されてβヒドロキシ酪酸へと変換されます。このアセト酢酸、βヒドロキシ酪酸、アセトンの3つをケトン体と言います(図)。
図:グルコース(ブドウ糖)が枯渇した状態で脂肪の摂取を増やすと、肝臓では脂肪酸のβ酸化が亢進されて生成されたアセチルCoAはケトン体の産生に振り分けられる。アセト酢酸とβヒドロキシ酪酸は血液を介して他の組織や細胞に運ばれて、アセチルCoAに変換されてTCA回路でATP産生に使用される。 脂肪酸と違ってケトン体は水溶性であるため、特別な運搬蛋白質の助けがなくても肝臓からその他の臓器(心臓や筋肉や腎臓や脳など)に効率よく運ばれ、細胞内でケトン体は再びアセチル-CoAに戻され、TCA回路で代謝されてエネルギー源となります。この際、エネルギー産生に使われるのはアセト酢酸のみで、βヒドロキシ酪酸はアセト酢酸に変換されて初めてエネルギー代謝に使用され、アセトンはエネルギー源にはならず呼気から排出されます(図)。
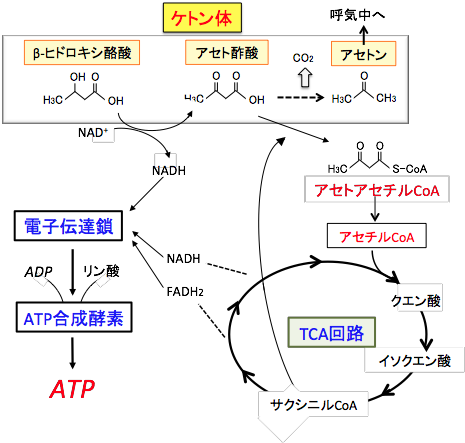
図:肝臓で生成されたケトン体(アセト酢酸とβヒドロキシ酪酸)は肝臓以外の組織の細胞に運ばれミトコンドリアのTCA回路と電子伝達系でATP産生に使われる。すなわち、βヒドロキシ酪酸からアセト酢酸への変換時とTCA回路での反応でNADHやFADH2に捕捉された電子は電子伝達鎖で受け渡され、最終的にATP合成酵素によってATPが合成される。 肝臓はケトン体を作り出しますが、ケトン体をエネルギー源として利用できません。肝臓はケトン体を他の臓器・組織のエネルギー源として供給するための工場で、作ったケトン体を自分で消費しないように酵素が欠損しているためです。
飢餓(あるいは絶食)時やインスリン欠乏による糖尿病などでグルコースが利用できない場合、ケトン体が重要なエネルギー源となります。脂肪酸は血液脳関門を通過できませんが、ケトン体は通過できるので、グルコースが利用できない場合の脳の唯一の代替エネルギーとなっています。
ケトン体は一部のアミノ酸からも産生されます。蛋白質はアミノ酸に分解されてから代謝されますが、アミノ酸ごとに代謝経路が異なります。アミノ酸のうち、脱アミノを受けたのち、その炭素骨格部分が脂質代謝経路に由来して、主として脂肪酸やケトン体合成に利用されるものをケト原性アミノ酸(ketogenic amino acid)と呼び、一方、TCAサイクルに入って糖産生に利用されるものを糖原性アミノ酸(glucogenic amino acid)と呼びます。アミノ酸は細胞内で蛋白合成の材料としてだけでなく、グルコースや脂肪酸が不足してエネルギー源がなくなると、蛋白質もアミノ酸に分解され、グルコースやケトン体に変換されてエネルギー産生に利用されるということです。
【インスリンの作用が正常ならケトン体は無害】
ケトーシス(ケトン症:ketosis)は血中のケトン体が増加した状態です。ケトン体のアセト酢酸とβヒドロキシ酪酸は酸性が強いので、ケトン体が血中に多くなると血液や体液のpHが酸性になります。このようにケトン体が増えて血液や体液が酸性になった状態をケトアシドーシス(ketoacidosis)と言います。
糖尿病性ケトアシドーシスは主に1型糖尿病患者に起こり、インスリンが不足した状態で脂肪の代謝が亢進し、血中にケトン体が蓄積してアシドーシス(酸性血症)を来たし、ひどくなると意識障害を来たし、治療しなければ死に至ります。
このように糖尿病の人では血液中のケトン体濃度の上昇は糖尿病の悪化を示すサインとして知られていますので、ケトン体は体に悪い物質と思われる方が多いと思います。しかし実際は、インスリンの働きが正常である限りケトン体は極めて安全なエネルギー源です。
肝細胞と赤血球(ミトコンドリアが無い)を除く全ての細胞で利用でき、日常的に産生されているからです。糖質を普通に摂っている人での血中ケトン体(アセト酢酸とβヒドロキシ酪酸の合計)の基準値は26~122μmol/lです。絶食すると数日で血中ケトン体は基準値の30~40倍もの高値になりますが、インスリンの作用が保たれている限り安全です。一時的に酸性血症(アシドーシス)になることもありますが、血液の緩衝作用によって正常な状態に戻ります。
つまり、ケトン体の上昇が怖いのは、インスリンの作用不足がある糖尿病の場合で、糖尿病性ケトアシドーシスはインスリン作用の欠乏を前提とした病態です。断食や糖質制限に伴うケトン体産生の亢進の場合は生理的であり、インスリン作用が正常であれば何の問題もないと言えます。