代謝をターゲットにしたがん治療:
がん細胞の代謝の特徴と、それをターゲットにしたがん治療法について紹介します。
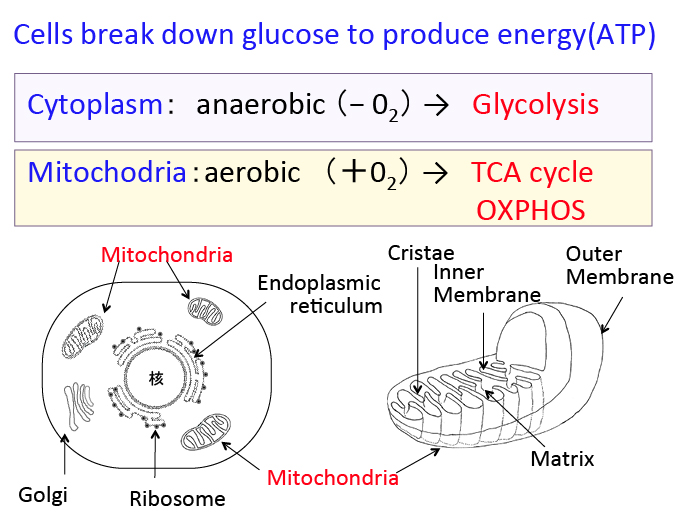
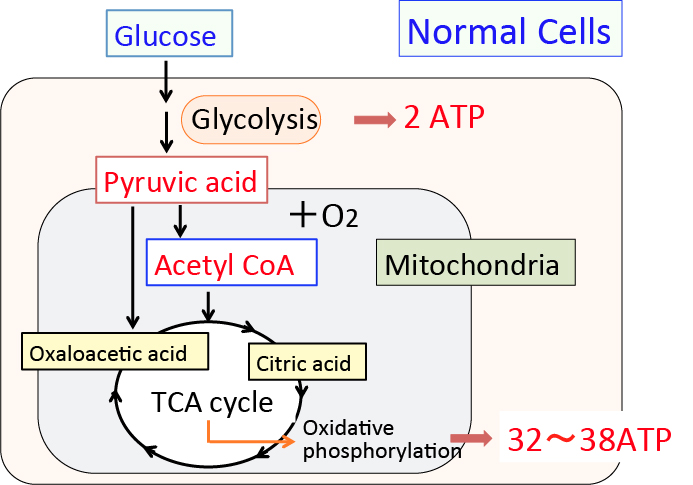
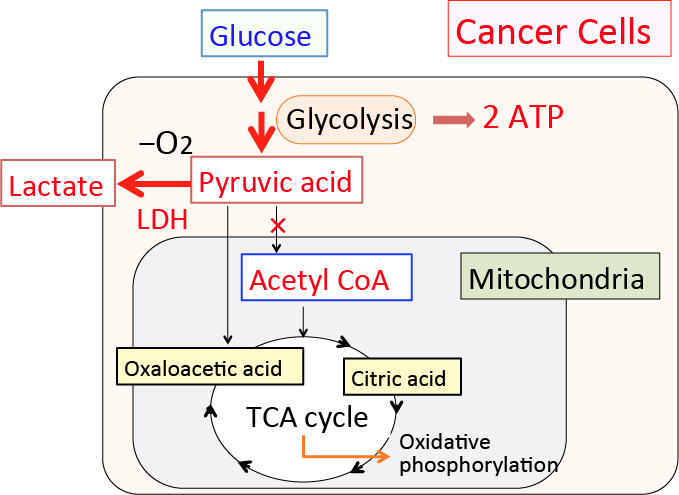
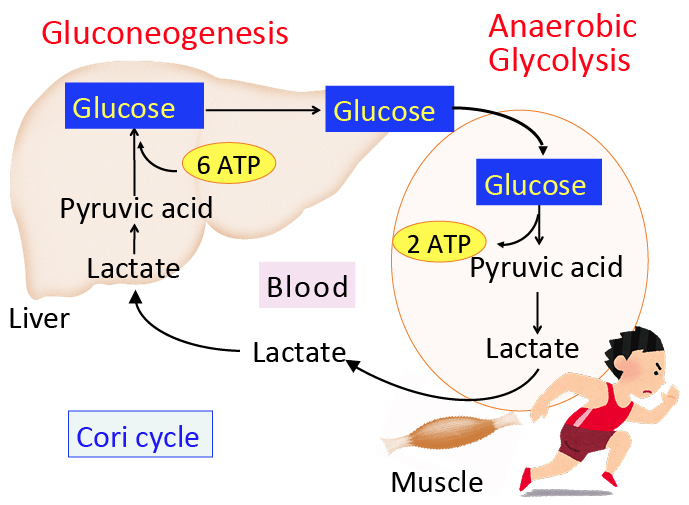
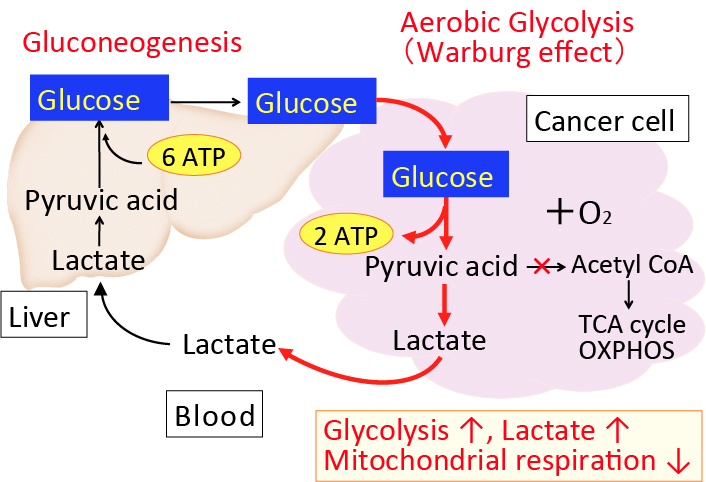
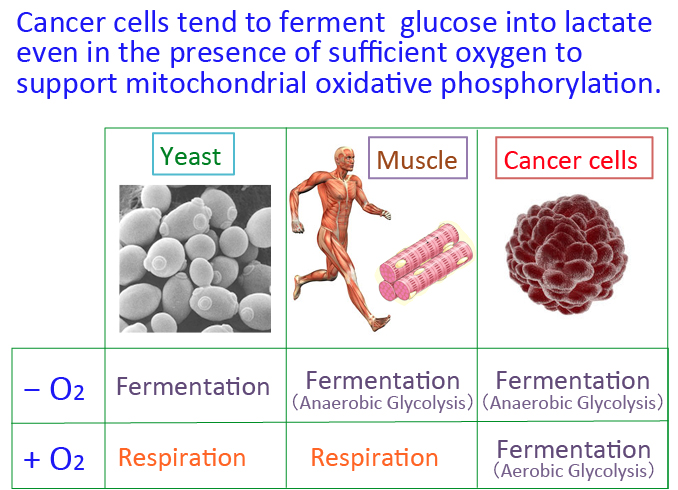
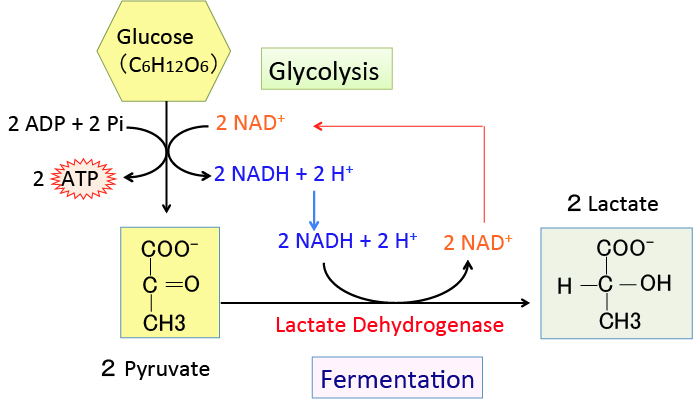
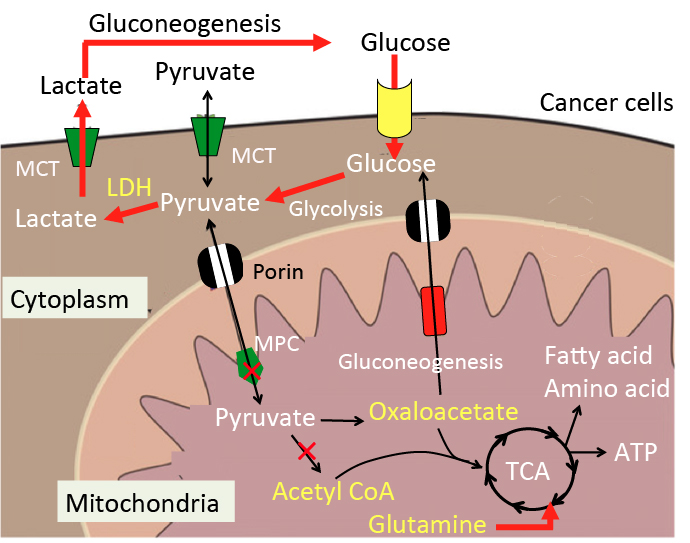
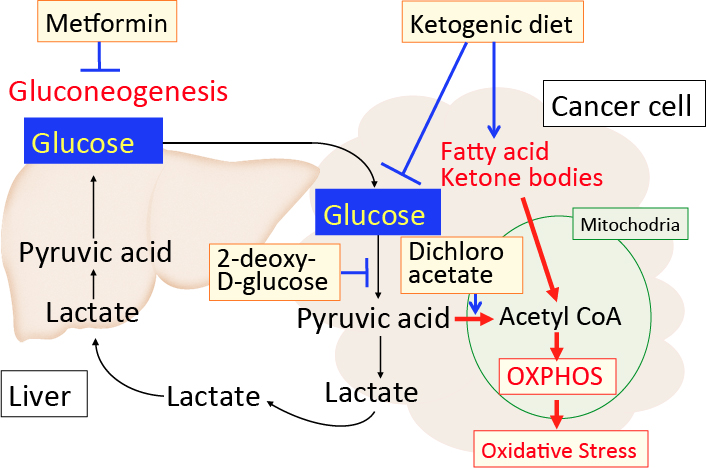
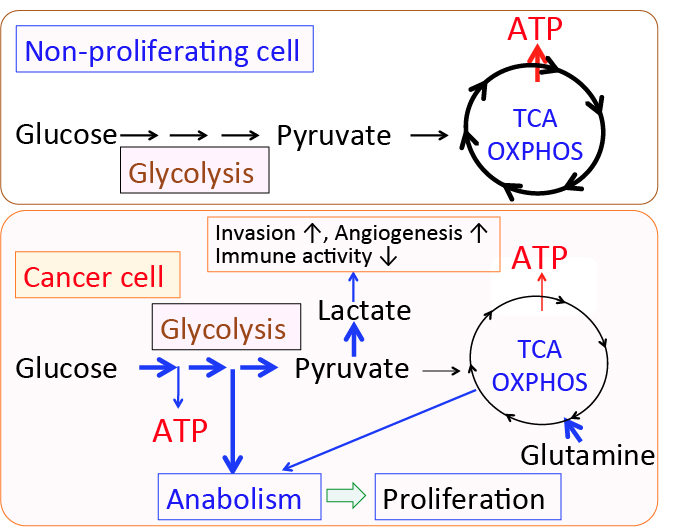
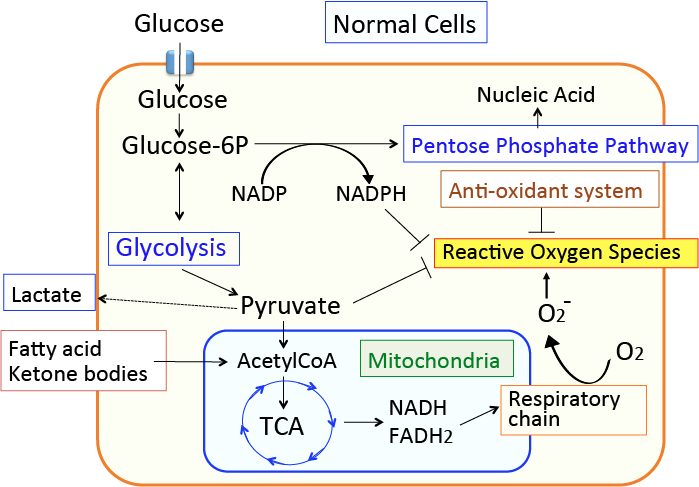
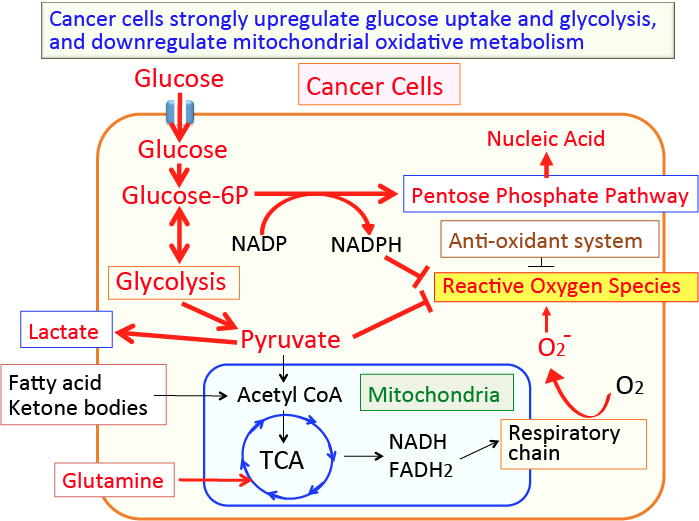
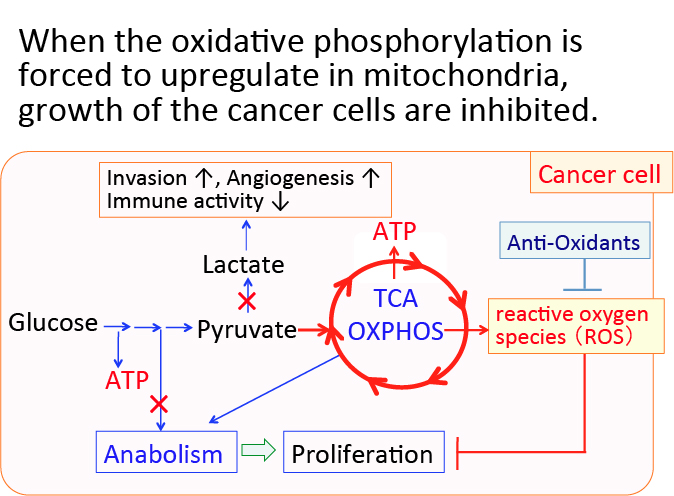
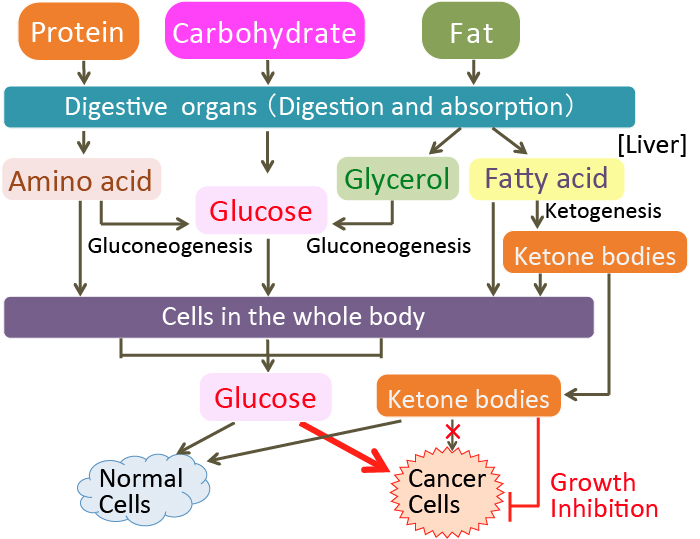
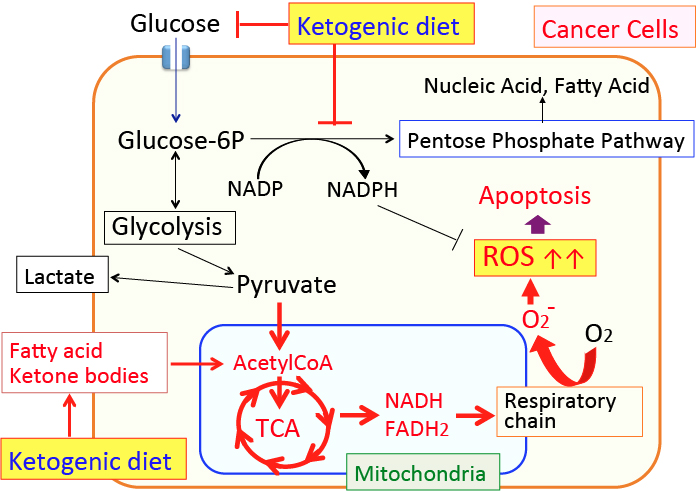
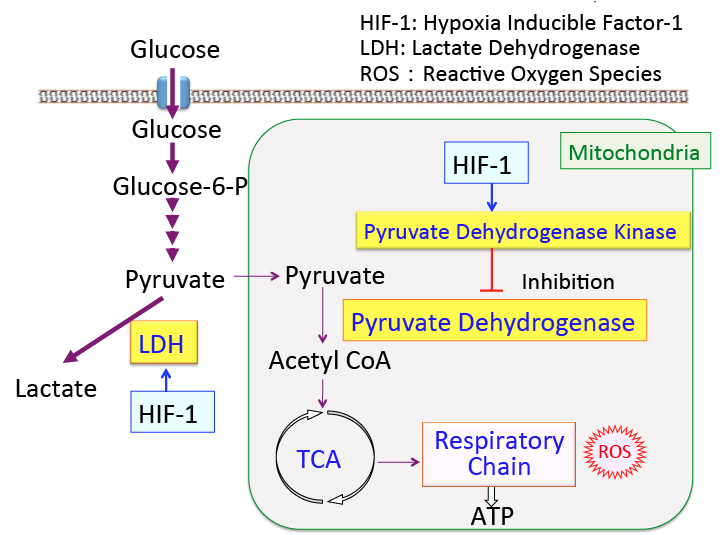
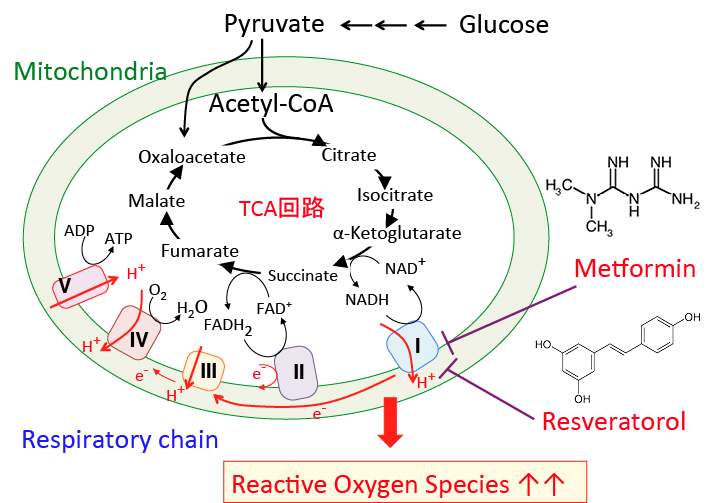
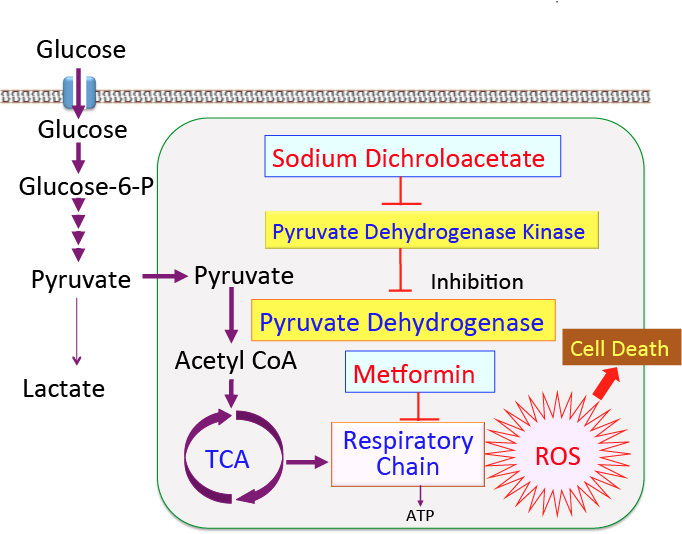
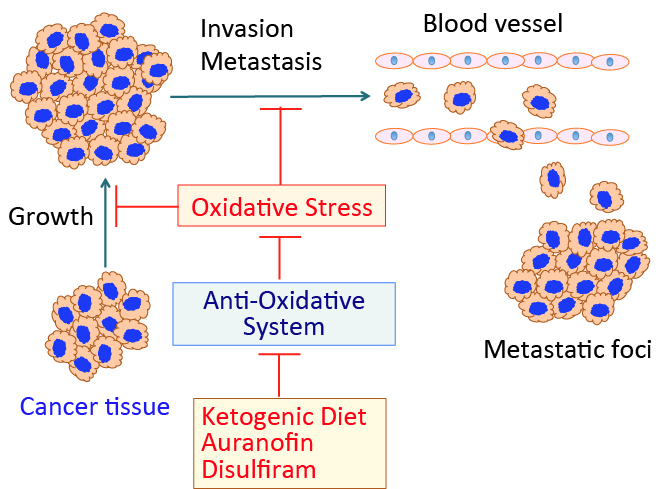
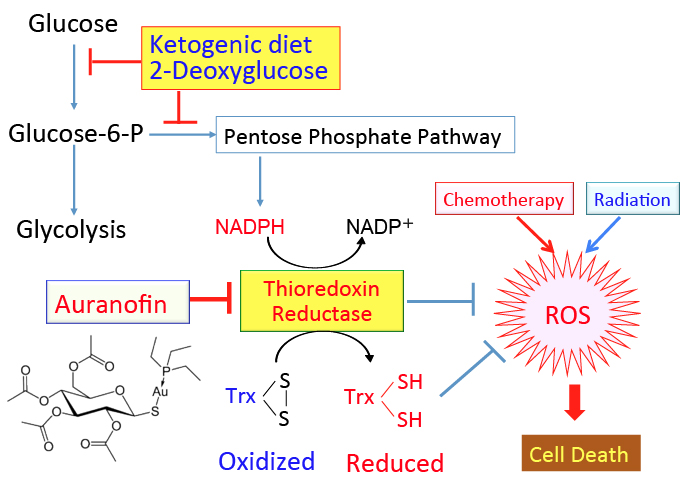
がん細胞のワールブルグ効果を是正するとがん細胞は自滅させることができます。
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
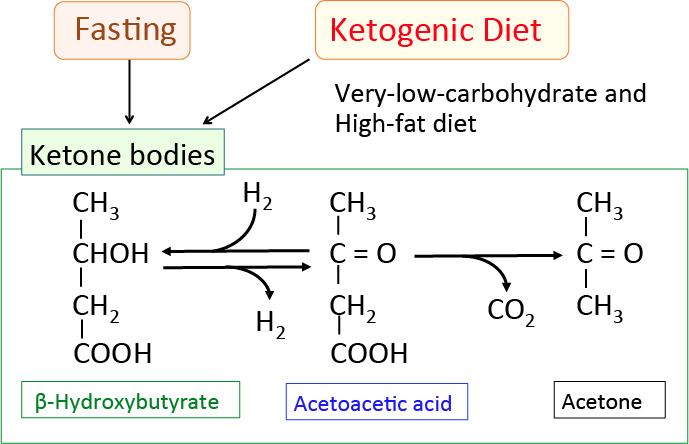 |
|
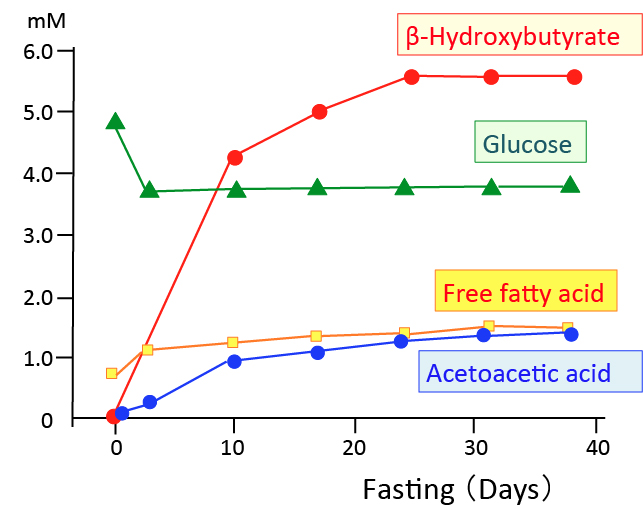 |
|
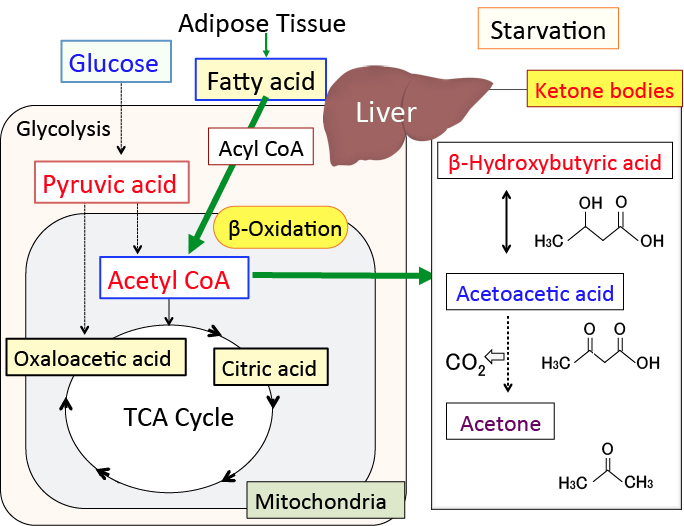 |
|
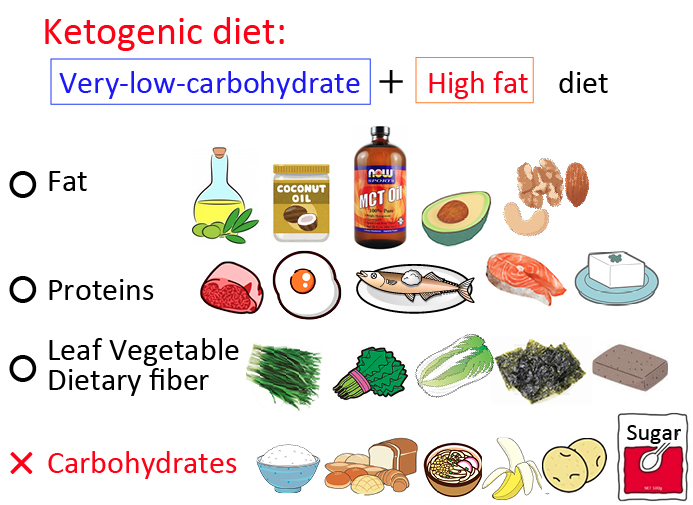 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
|
|
|
|
がん細胞の代謝の特徴と、それをターゲットにしたがん治療法について紹介します。
がん細胞のワールブルグ効果を是正するとがん細胞は自滅させることができます。
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
 |
|
|
|
|
|