◇ 筋萎縮性側索硬化症(ALS)の代替療法
ALSは進行の早い致死的な病気です。進行を抑える方法を実践するしかありません。
効果が期待できる代替療法を紹介しています。
■
【筋萎縮性側索硬化症は運動ニューロンが死滅して発症する】
筋萎縮性側索硬化症(Amyotrophic lateral sclerosis:ALS)は、脳や末梢神経からの命令を筋肉に伝える神経細胞(運動ニューロン)の障害で発症する神経変性疾患の一つです。
手や足や顔など、自分の思いどおりに体を動かすときに必要な随意筋を支配する神経を運動ニューロンといいます。 運動ニューロンは、歩行や物を持ち上げたり、飲み込んだりするなど、いろいろな動作をするときに、脳の命令を筋肉に伝える役目をしています。
この運動ニューロンが侵されると、筋肉を動かそうとする信号が伝わらなくなり、筋肉を動かしにくくなったり、筋肉がやせ細ってきます。
運動系が広範に障害されますが、感覚神経や自律神経系や認知機能の障害は通常認めません。
運動ニューロンの変性・消失によって進行性の筋肉の萎縮と筋力低下をきたし、進行が早く、患者さんの半数ほどは発症後3年から5年で呼吸筋麻痺により死亡します。(人工呼吸器の装着による延命は可能)。
大リーグの国民的人気選手であったルー・ゲーリッグ(1941年に死亡)がこの病気に罹患したことから別名「ルー・ゲーリッグ病 (Lou Gehrig's disease)」とも呼ばれています。
日本での発病率(1年間に発症する率)は人口10万人当たり1.1〜2.5人で、50歳代から発症率が上昇しはじめて、60歳代から70歳台で最も発症率が高く、80歳台では減少傾向となります。 日本での有病率は人口10万人当たり7〜11人で、平成25年度の特定疾患医療受給者数によると全国で約9,200人がこの病気に罹患しています。
【ALSは有効な治療法がまだ無い】
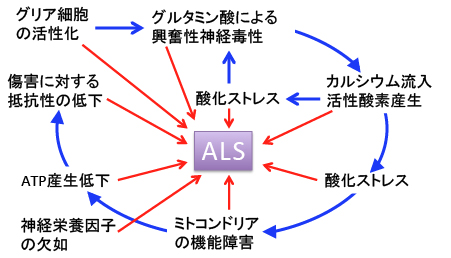
病理学的には運動ニューロンの選択的な変性・消失がALS発症の原因ですが、「なぜ運動ニューロンが選択的に脱落するのか」というメカニズムに関してはまだ不明です。 いろんな仮説が報告されています。
代表的なものがグルタミン酸による興奮性神経毒性(glutamate excitotoxicity)です。
グルタミン酸は神経系においては、グルタミン酸受容体を介して興奮性の刺激を神経シナプス間で伝達する物質で、記憶・学習などの脳高次機能に重要な役割を果たしています。
一方、脳虚血などで細胞外に放出されると神経毒として作用し、神経細胞の細胞死を引き起こすことが知られています。 グルタミン酸受容体が活性化されると細胞内のカルシウム濃度が上昇し、細胞死が誘導されます。 このグルタミン酸の興奮性神経毒性がALSにおける神経細胞死に関与していると考えられています。
さらにカルシウム流入と活性酸素の産生もまたALSの病態に関係があると考えられています。ALSにおける活性酸素の重要性は、一部の家族性ALSがスーパーオキシド・ディスムターゼ 1 (SOD1)の変異により引き起こされることが明らかになって以来注目されています。
SOD1は活性酸素のスーパーオキシドの消去酵素で、最近では、活性酸素のよる酸化傷害は家族性ALSのみならず孤発性ALSにおいてもその病態に関係があるというデータが蓄積されつつあります。現時点では、ALSに対して根治を期待できる治療法はありません。
ALSの治療薬として、グルタミン酸による神経毒性や活性酸素による酸化傷害の軽減をターゲットにした薬が使われています。
グルタミン酸放出抑制剤のリルゾール(商品名:リルテック)は進行を遅らせることが確かめられており、日本でも1999年より健康保険の適用になっています。しかし、「ALS患者の生存期間や人工呼吸器装着までの期間を約3ヵ月間延長させる」というレベルの効果です。
急性脳梗塞などの治療薬として使われてきたフリーラジカル消去剤のエダラボン(商品名:ラジカット)が「筋萎縮性側索硬化症における機能障害の進行抑制」として効能・効果の承認を2015年6月に受けています。
比較的早期の患者を対象にした臨床試験で、日常生活機能の評価スコアでプラセボ群と統計的有意差が認められています。「24週(約6ヵ月)の試験期間において、ALSによる機能障害の進行を約2ヶ月分遅延させることが期待できる」という結果が報告されています。
グルタミン酸放出抑制剤やフリーラジカル消去剤を併用すると、ALSの進行を遅くする効果は期待できますが、進行をストップさせるほどの効果は得られていないようです。
そこで、このような標準治療に加えて、ALSの進行を抑制する効果が期待できる代替医療を検討することも重要です。
【ミトコンドリアを活性化する治療法が注目されている】
神経毒として作用するグルタミン酸は、カルシウム流入を引き起こして活性酸素の産生を高め、活性酸素はミトコンドリアの酸化傷害を引き起こします。 ミトコンドリアが損傷して機能が低下すると、ATPの産生が低下し、細胞のエネルギー供給が減少すると細胞は興奮性神経毒性に対して抵抗力が弱くなります。 この悪循環を薬物治療で断ち切ればALSの進行を遅らせることが可能と考えられています。
つまり、グルタミン酸の神経毒性の抑制、活性酸素による酸化傷害の抑制、ミトコンドリア障害の抑制と機能の活性化の組合せの可能性が指摘されています。
図:様々な要因がALS(筋萎縮性側索硬化症)の発症原因に関与している。グルタミン酸の放出抑制、酸化ストレスの軽減、ミトコンドリアの活性化、神経栄養因子の産生刺激、グリア細胞の活性化抑制などが治療の主なターゲットになる。 サプリメントを使ったALSの治療法としてDeannaプロトコール(Deanna protocol)というのがあります。 これは抗酸化剤(グルタチオン、ニコチンアミド・アデニン・ジヌクレオチド、コエンザイムQ10、ユビキノール)、中鎖脂肪酸(MCT)、アルギニン、αケトグルタール酸、GAGA(γアミノ酪酸)などが入っており、神経細胞のミトコンドリアの酸化傷害を防ぎながら、ミトコンドリアでのTCA回路と酸化的リン酸化を亢進してATP産生を増やすことを目的にしています。
このように、神経細胞のミトコンドリアの機能が低下してエネルギーのATP産生が低下して細胞死が起こることがALSの発症メカニズムに関与しているという報告が増えています。 以下のような論文があります。Metabolic Dysfunctions in Amyotrophic Lateral Sclerosis Pathogenesis and Potential Metabolic Treatments(筋萎縮性側索硬化症の発症における代謝異常と代謝治療の可能性)Front Neurosci. 2016; 10: 611.
【要旨】
筋萎縮性側索硬化症(Amyotrophic lateral sclerosis:ALS)は致死性の神経変性疾患であり、大脳と脊髄における運動神経の脱落によって特徴づけられる。 運動神経の細胞死は筋肉の神経支配が無くなり、筋肉の萎縮や麻痺を引き起こし、最終的には呼吸機能の麻痺から死に至る。
ALS患者やALSの動物実験モデルの研究から、ALSの発症とその進展の機序にエネルギー代謝の異常が関与していることを示すエビデンスが増えている。 特に、糖代謝の低下とミトコンドリア機能の異常が中枢神経系組織や筋肉組織のATPの利用を妨げている。
ALSにおけるミトコンドリア機能の改善を目標にした代謝治療が幾つか試みられており、ALSの機能改善に様々な効果を示している。
ALSの実験モデルにおいて代謝をターゲットにした治療の効果は、運動障害の発症を遅らせ、運動神経を保護し、生存期間を延長することが明らかになっており、ALSの発症メカニズムに代謝の異常が重要な関与をしていることを示している。 ALSに対する代謝治療の有効性を検証する比較対照臨床試験を早急に実施する必要がある。
さらに、ALS患者やALSの動物実験モデルにおけるエネルギー代謝の異常を解明することは、代謝をターゲットにした有効な治療法の開発に必要であり、このような治療法はALSの進行を遅らせ、ALS患者の延命につながる。神経細胞のエネルギー源はグルコース(ブドウ糖)ですが、ALSの運動ニューロンではグルコースの取込みも代謝も低下し、ミトコンドリアでのATP産生が低下してエネルギー不足になって細胞死が引き起こされているので、ミトコンドリアの働きを高める方法はALSの進行を抑制できるという考えです。
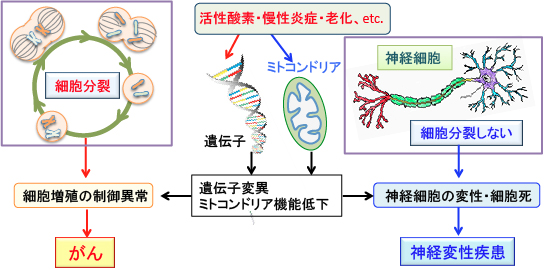
がん細胞では、解糖系が亢進しミトコンドリアでの酸化的リン酸化が抑制されています。この場合、ミトコンドリアの機能を亢進するとがん細胞は自滅します。 一方、神経変性疾患では、ミトコンドリアの働きが低下してATP産生が低下して死滅するので、ミトコンドリアの働きを亢進すると、神経細胞死を避けることができるということです。
がん細胞は日頃から細胞分裂を行っている組織から発生する。遺伝子変異の蓄積によって細胞分裂の制御ができなくなるとがん細胞になる。神経細胞は細胞分裂しないので、細胞増殖の制御異常でがん化することは無い。しかし、再生できないので、ダメージによって変性や細胞死によって数が減少すると、ALSやアルツハイマー病などの神経変性疾患が発症する。がん細胞も神経変性疾患のニューロンもミトコンドリアの機能が低下している。ミトコンドリアを活性化すると、がん細胞は自滅し、神経変性疾患は進行が遅くなる。
【肥満の方が生存期間が長い】
ALSでは栄養状態が良いほど生存期間が長いことが明らかになっています。
ALSの動物実験モデルを使った実験では、高脂肪食で運動ニューロンの死滅が減少し、生存期間が20%延長したという報告があります。 高脂肪食(脂肪47%、炭水化物38%、たんぱく質15%)と普通食(脂肪17%、炭水化物64%、たんぱく質15%)の比較では、普通食の生存期間が180日以下に対して高脂肪食では220日(一部のマウスは270日以上生存)という結果が報告されています。
BMI(body mass index)とALS患者の生存期間が比例するという報告があります。 100万人以上を14〜28年間追跡して前向き試験では、標準体重の人より肥満の人の方がALSを発症するリスクは30〜40%低いという結果が報告されています。 結論的には、少し肥満になるくらいにカロリーオーバーの食事がALSの生存期間を延ばす効果が期待できるということです。
【ALSの代謝治療】
この論文の中で、ミトコンドリアの働きを高めるサプリメントや薬や食事療法が解説されています。その多くは、ミトコンドリアを活性化してがん細胞を自滅させる治療に使われています。 以下のようなものが記載されています。
ケトン食とカプリル酸トリグリセリド:
ケトン食は高脂肪+超低糖質食によって血中のケトン体(アセト酢酸、βヒドロキシ酪酸)を増やす食事です。 ケトン体は、グルコースの代替エネルギー源として神経細胞に利用され、ミトコンドリアでATP産生に使われます。
中鎖脂肪酸の炭素数8個のカプリル酸は肝臓で速やかに代謝されてケトン体の産生を高めます。 米国では中鎖脂肪酸トリグリセリド(中鎖脂肪酸中性脂肪)のカプリル酸トリグリセリドがアルツハイマー病の治療に有効な医療食( medical food) として認可されています(2009年3月にFDAが認可)。
神経細胞はグルコース(ブドウ糖)とケトン体しかエネルギー源として利用できないのですが、アルツハイマー病ではグルコースの取り込みや利用に障害があり、そのため中鎖脂肪酸を摂取してケトン体の産生を増やすと神経組織のエネルギー産生が改善して症状が良くなると考えられています。
ケトン体のβヒドロキシ酪酸には、抗炎症・抗酸化・抗アポトーシスの機序による神経細胞保護作用が報告されています。 βヒドロキシ酪酸のサプリメントも販売されています。 (詳細はこちらへ)ケトン食が、アルツハイマー病や脳外傷や脊髄損傷や脳虚血の治療に有効であることが報告されています。 ケトン食や中鎖脂肪酸による神経保護作用や神経機能改善効果に関しては多くの基礎研究で確認されています。
ケトン食を実践する場合、体重が減少しやすいのですが、体重を減らさないように脂肪やたんぱく質を多く摂取することが大切です。肥満の方が生存期間が長いという結果が出ているからです。
脂肪は、脳の働きに良いオメガ3系不飽和脂肪酸(DHAやEPAやαリノレン酸)、中鎖脂肪酸、オリーブオイルを多く摂取し、オメガ6系不飽和脂肪酸や動物性脂肪を減らすことが重要です。ジクロロ酢酸(Dichloroacetate):
ジクロロ酢酸(DCA)はピルビン酸脱水素酵素キナーゼを阻害してピルビン酸脱水素酵素を活性化します。ピルビン酸脱水素酵素はピルビン酸をアセチルCoAに変換する酵素で、ミトコンドリアでのTCA回路での代謝を亢進します。 がん細胞のミトコンドリアを活性化するときも良く使います。
DCAはミトコンドリアでのグルコース代謝とATP産生を亢進します。 ALSの動物実験モデルでDCAは脊髄の運動ニューロンの減少を25%抑制し,ALSの運動機能障害の発症を遅らせ、生存期間を延ばす効果が報告されています。 (DCAはこちらへ)コエンザイムQ:
ミトコンドリアにおける呼吸鎖における電子受容体の一つで、強力な抗酸化作用を持ち、フリーラジカルを消去します。(詳しくはこちらへ)
アセチル-L-カルニチン:
アセチル-L-カルニチン(Acetyl-L-Carnitine)はL-カルニチン(L-Carnitine)にアセチル基(CH3CO-)が結合した体内成分です。L-カルニチンは、生体の脂質代謝に関与するビタミン様物質で、アミノ酸から体内で生合成されます。
L-カルニチンは脂肪酸と結合し、脂肪酸をミトコンドリアの内部に運搬する役割を担っています。 体内のL-カルニチンのうち一部はアセチル-L-カルニチンの状態で存在します。
アセチル-L-カルニチンは、血液脳関門を通過して脳内に到達し、アセチルコリンの量を増やします。アセチルコリンは副交感神経や運動神経の末端から放出される神経伝達物質で、アセチルコリンの減少はアルツハイマー病との関連が指摘されています。実際に、アセチル-L-カルニチンはアルツハイマー病初期症状の改善に効果があることが報告されています。 アセチル基はアセチルCoAの合成にも使われます。
つまり、アセチル-L-カルニチンは神経細胞のミトコンドリアでの酸素呼吸(酸化的リン酸化)を亢進し、筋肉細胞での脂肪酸のβ酸化を亢進します。 脳外傷、脊髄損傷、脳虚血、脳卒中、アルツハイマー病などの疾患の治療に有効性が示されています。(詳しくはこちらへ)レスベラトロール:
レスベラトロールはスチルベン合成酵素によって合成されるポリフェノールの一種です。 気候変動やオゾン、日光、重金属、病原菌による感染などによる環境ストレスに反応して合成されます。 赤ぶどうの果皮や赤ワインに多く含まれています。 その他、ラズベリー、ブルーベリー、マルベリー (桑の実)、イタドリなどにも含まれます。 抗酸化作用や寿命延長効果が知られています。 消化管からの吸収率が低いので、吸収率を高めた製品を摂取することが重要です。(詳しくはこちらへ)
【R体αリポ酸と水素ガス吸入】
この論文には記載されていませんが、抗酸化作用のあるものとしてR体αリポ酸と水素ガス吸入が有効です。 R体αリポ酸はピルビン酸脱水素酵素の補酵素になるので、ミトコンドリアの活性化にも有効です。(詳しくはこちらへ)
水素ガス(分子状水素:molecular hydrogen)はヒドロキシラジカルを選択的に消去したり抗酸化酵素を誘導する作用(抗酸化作用)、炎症性サイトカインの産生抑制や炎症性の転写因子の抑制などの抗炎症作用があります。
水素ガスは様々な炎症性疾患(自己免疫疾患など)や神経変性疾患(アルツハイマー病やパーキンソン病など)、呼吸器疾患、循環器疾患、糖尿病、腎障害など多くの疾患に対して治療効果を示すことが報告されています。
水素分子は無味無臭のガスで、脂質膜を通って速やかに拡散し、細胞内に入り、ミトコンドリアや核といった細胞内小器官に容易に達することができます。
水素ガスは室温および触媒の不存在下では不活性の気体です。 水素は容易に血液脳関門を通過し、神経組織の細胞に到達します。
細胞毒性などの有害作用はなく、生理的には、腸内細菌が複合糖質の発酵によって体内でも産生されています。そのため、動脈血には水素が含まれており、この水素を細胞が利用していることを示唆しています。
水素はフリーのヒドロキシラジカルとは反応しますが、その他の活性酸素とは反応しません。ヒドロキシラジカル以外のフリーラジカルはシグナル伝達などの生理的な機能にも役割を担っているので、ヒドロキシラジカルだけを消去することは理論的な利点になります。
実際に、様々な実験モデルで、水素はヒドロキシラジカルを消去する作用によって脳組織の酸化傷害から神経細胞を保護する効果が報告されています。
体内に水素を投与する方法として、水素含有水の飲用はほとんど効果が期待できません。 水素が水に飽和した状態での水素の量は0.8mM(1.6ppm)程度です。つまり、水素で飽和した水素水を1リットル飲んでも1.6mgの水素を摂取したに過ぎません。
一方、体内では腸内細菌が1日に1リットル程度の水素を発生していると言われています。(実際は、食事の内容などで産生量は個人差があります)
1リットルの水素ガスは、1モルの水素(H2)は2グラムで、体積は22.4リットルになるので(22.4リットルの中にアボガドロ数の約6x(10の23乗)個の水素分子が存在する)、腸内細菌が1日に発生する1リットルの水素は約90mgになります(2÷22.4=0.0892857)。 つまり、体内で毎日100mg(1リットル)程度の水素が腸内で産生されている条件では、水素が飽和した水を1リットルを飲用して体内に1.6mgの水素を摂取しても、どれだけの効果があるのかという議論があります。
ALSの代替医療として水素ガスを吸入する方法は試してみる価値があります。
(水素ガス吸入についてはこちらへ)
【ALSとカンナビノイド】
大麻成分のカンナビノイドは脳虚血による神経細胞死を抑制する作用があります。 脳組織の低酸素や虚血は神経細胞を死滅させる最も一般的な原因となっています。
神経組織が虚血になってグルコースや酸素の供給が止まると、グリア細胞のアストロサイトに乳酸が蓄積して酸性になり、興奮性アミノ酸のグルタミン酸を放出します。グルタミン酸はグルタミン酸受容体を介して興奮性の刺激を伝達する物質ですが、細胞外に放出されると神経細胞に非常に危険な毒性を示します。グルタミン酸受容体が活性化されると細胞内のカルシウム濃度が上昇し、細胞死が誘導されます。
大麻成分のカンナビジオールはグリア細胞の活性化を抑制し、グルタミン酸による神経細胞のダメージを抑制する作用が報告されています。 カンナビジオールはカンナビノイド受容体のCB1とCB2には作用しません。カンナビジオールが作用する受容体やタンパク質が多数報告されていますが、その中には細胞内への電解質などの物質の出入りを調節する様々な種類のイオンチャネルやトランスポーター、細胞のシグナル伝達に関与する受容体や酵素などが含まれ、これらの物質を活性化したり抑制する作用が報告されています。
精油のβカリオフィレンはカンナビノイド受容体CB2のアゴニストです。CB2の活性化は筋萎縮性側索硬化症に効く可能性があります。 (詳しくはこちらへ)
βカリオフィレンとカンナビジオールは相乗効果が期待できます。内因性カンナビノイドの一種のパルミトイルエタノールアミドもアストロサイトやミクログリアの活性化を抑えて神経組織の炎症を抑制する機序で神経変性疾患に効く可能性があります。 (詳しくはこちらへ)
以上をまとめると、ALSの代替医療として試してみる価値があるのは、カロリーが多めに設定したケトン食、カプリル酸トリグリセリトなどの中鎖脂肪酸、βヒドロキシ酪酸のケトンサプリメント、ジクロロ酢酸ナトリウム、コエンザイムQ10、アセチル-L-カルニチン、カンナビジオール、βカリオフィレン、パルミトイルエタノールアミドということになります。 これらは、まだ臨床試験で効果が確認されてはいませんが、ALSは進行を止められなければ半数くらいは3〜5年で呼吸筋麻痺で人工呼吸器が必要になる疾患なので、ある程度のエビデンスのある方法を組み合せて実践するしかありません。
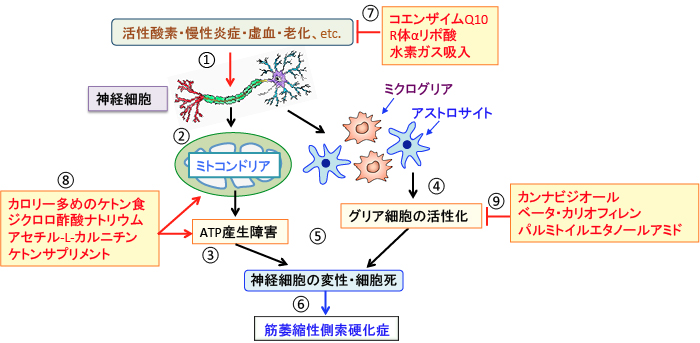
図:活性酸素や慢性炎症や虚血や老化などによって神経細胞が傷害されると(①)、ミトコンドリアでのATP産生が障害され(②)、神経細胞の変性や細胞死が誘導される(③)。一方、炎症などの刺激によってグリア細胞が活性化されると(④)、神経細胞の変性・細胞死が誘導される(⑤)。神経細胞の変性や細胞死は筋萎縮性側索硬化症(ALS)などの神経変性疾患を引き起こす(⑥)。コエンザイムQ10やR体αリポ酸や水素ガス吸入は抗酸化作用によって神経傷害を抑制できる(⑦)。カロリーが高めのケトン食、ジクロロ酢酸、アセチル-L-カルニチン、ケトンサプリメントなどでミトコンドリアの働きを高めてATP産生を増やし(⑧)、グリア細胞の活性化を抑制するカンビジオール、ベータ・カリオフィレン、パルミトイルエタノールアミド(⑨)などを併用すると、筋萎縮性側索硬化症の進行の抑制に効果が期待できる。
【ニコチンアミド・リボシドとニコチンアミド・モノヌクレオチドはNADを増やしてALSの進行を抑制する】
NAD +(ニコチンアミドアデニンジヌクレオチド)はナイアシンというビタミンから体内で合成されます。NAD +は解糖系およびミトコンドリアでのエネルギー産生反応に必要な因子です。NAD +レベルは加齢とともに低下し、加齢に関連する疾患の発症に重要な役割を担っていることが明らかになっています。 NAD +の細胞内レベルを上昇させる方法は、動物モデルで老化を遅らせ、筋肉機能を回復させ、脳での神経再生を促進し、代謝性疾患を改善することが示されています。 筋萎縮性側索硬化症(ALS)の治療にもNAD +の細胞内レベルを上昇させる方法の有効性が指摘されています。 以下のような報告があります。
【要旨】
筋萎縮性側索硬化症(ALS)は、運動ニューロンの進行性変性を特徴とする。多様なALSの動物モデルの星状膠細胞(Astrocyte)は、神経細胞との共培養で運動ニューロンの細胞死を誘導する。 NAD +の利用性を高める、またはNAD +依存型脱アセチル化酵素のSIRT3とSIRT6の発現を増やすと、細胞培養モデルでの神経毒性が阻止される。
マウスのALSモデルでNAD +の利用性を高める効果を評価するために、NAD +を消費する酵素(CD38)の阻害と生体利用可能なNAD +前駆体(ニコチンアミドリボシド)の補給という2つの戦略を使用した。
CD38の活性阻害は、hSOD1にリンクした2種類のALSマウスモデルの生存に影響を与えなかった。
一方、ニコチンアミド・リボシドの補充は運動ニューロンの変性を遅らせ、脊髄の神経炎症のマーカーを減少させ、筋肉の代謝を変化させ、hSOD1マウスの生存を適度に増加させた。 さらに、ALS患者における脊髄におけるNAD +合成に関与する酵素(NAMPTおよびNMNAT2)の発現の変化と、SIRT6発現の低下を確認した。
これは、人間のALSの病理において、NAD +に関連した神経保護経路の欠損を示唆している。 私たちのデータは、ALSにおけるNAD +レベルの増加による治療の可能性を示唆している。
さらに、NAD +レベルを高める治療がALSの動物モデルの病状改善に有効であり、生体利用可能なNAD +の前駆体を使用してNAD +レベルを高めることがALSの治療法として有望であることを示唆している。ニコチンアミド・リボシドをサプリメントとして補充すると体内のNAD +レベルを高めることができます。つまり、ALSの治療にニコチンアミド・リボシドの補充療法が有効である可能性を示唆しています。
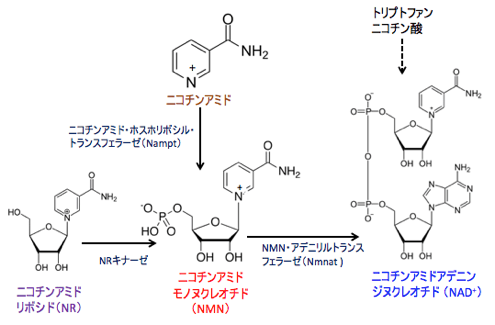
図:ニコチンアミド・アデニン・ジヌクレオチド(nicotinamide adenine dinucleotide:NAD +)はトリプトファンやニコチン酸やニコチンアミドなどから生成するルートもあるが、特にNAD +の前駆物質であるニコチンアミド・モノヌクレオチド(nicotinamide mononucleotide:NMN)とニコチンアミド・リボシド(nicotinamideriboside:NR)をサプリメントとして摂取すると体内のNAD +を増やすことができる。
○ ニコチンアミド・リボシドとジクロロ酢酸ナトリウムはALSの治療において相乗効果が期待できます。
(詳しくはこちらへ)○ ニコチンアミド・リボシドとニコチンアミド・モノヌクレオチドについてはこちらへ: